Al menos tres antivirales en forma de píldora, contra el COVID-19, están en fases avanzadas de pruebas clínicas y se espera que, en solo cuestión de meses, estén listos para llegar al público, de acuerdo con Carl Dieffenbach, director de la División de Sida del Instituto Nacional de Alergias y Enfermedades Infecciosas de Estados Unidos.
De acuerdo al portal web Expansión.mx, la llegada de estas píldoras antivirales podría suponer el regreso a la vida normal y el fin de la pandemia de COVID-19. Esto es así porque estos medicamentos actúan directamente sobre el sistema inmunológico ante una infección de COVID, limitando su avance, la replicación del virus y el tiempo de su duración. De tal manera que los casos graves de coronavirus serían cada vez más la excepción.
Carl Dieffenbach, director de la División de Sida del Instituto Nacional de Alergias y Enfermedades Infecciosas de Estados Unidos, es quien supervisa el desarrollo de este tipo de antivirales y, según comentó a la revista especializada Kaiser Healt News, los resultados de los tres principales desarrollos de píldoras anti-COVID podrían llegar a finales de este año.
Las tres píldoras anti-COVID que están a punto de concretarse
Merck & Co. y Ridgeback Biotherapeutics lideran la carrera para crear la pastilla contra el COVID-19 a través de su medicamento molnupiravir. Pero también existen grandes avances en el desarrollo de Pfizer (PF-07321332), y el AT-527, un antiviral producido por Roche y Atea Pharmaceuticals.
El molnupiravir afecta principalmente la capacidad de reproducción del virus en el organismo, haciendo que la enzima que copia el material genético viral cometa múltiples errores. Al reducir la carga viral en los pacientes y acortar el tiempo de infección, evita una respuesta inmunitaria peligrosa que desencadene en la muerte.
En los ensayos clínicos realizados por Merck, en el caso del molnupiravir, se han encontrado resultados prometedores, al reducir significativamente la carga viral de los pacientes. Y el CEO de la empresa, Robert Davis, indicó que los ensayos de fase 3 tendrían resultados en la próxima semana y no solamente eso, Merck solicitaría el uso de emergencia de su píldora a la Administración de Alimentos y Medicamentos de Estados Unidos (FDA) antes del fin de año.
De concederse esta aprobación, la farmacéutica estaría preparada para producir 10 millones de tratamientos para finales del año. (EXPANSIÓN.MX)
Autor

Otros artículos del mismo autor
COAHUILA25 abril, 2024Presente Coahuila en el Auto Show Beijing 2024
SALTILLO25 abril, 2024Javier Díaz se compromete a agilizar trámites municipales
ENCABEZADO25 abril, 2024Celebran alcalde y Cabildo 130 años de la Normal
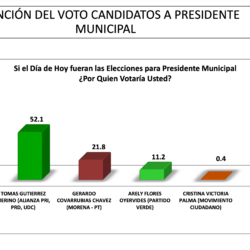
RAMOS ARIZPE25 abril, 2024Adelanta Tomás Gutiérrez en Ramos Arizpe, lleva una ventaja de 30 puntos